- 实体识别
近日,Ambrx Biopharma向美国SEC递交了招股书,准备在美国纽交所上市。 Ambrx曾在2014年向美国纳斯达克递交过上市申请,由于估值过低,Ambrx撤销了IPO程序,并接受由复星医药领投,与厚朴投资、光大控股医疗健康基金以及药明康德组成联盟的共同收购,此后 Am br x 调整了团队配置和业务战略方向,公司经营管理层由华人担任,研究方向聚焦在癌症领域。
Ambrx对于大家并不陌生,主要通过遗传密码扩增平台开发蛋白质疗法,包括抗体药物偶联、免疫调节蛋白、双特异性抗体及其它治疗性蛋白药物,曾与浙江医药、百济神州、中国生物制药都建立过项目开发合作。 Am br x 与浙江医药合作的 抗体偶联药物 ARX78 8在美国进入FDA的快速通道,在中国则于5月25日被CDE正式 授予突破性治疗药物。今年初的 1月13日,中国生物制药也宣布 与 Ambrx签订合作协议,基于后者 独特的 非天然氨基酸掺入技术平台 开发两款创新生物药。
作为抗体偶联技术的一种,基于 非天然氨基酸(non-natural amino acid, nnAA)的抗体偶联技 术 也有其他一些进展,比如 Sutro开发的代表性双靶点(EGFR/MUC1)特异性抗体偶联药物M1231也公示了临床信息,说明 nnAA 偶联技术也在持 续突 破。
非天然氨基酸的抗体偶联技术,与其他定点偶联技术一样,本质上也是在解决随机偶联技术所造成的产品批间不均一、稳定性差、潜在毒性等各种问题。 非天然氨基酸的抗体偶联技术最复杂、最主要的工作是在抗体的制备阶段,即如何在抗体中插入非天然的氨基酸。 非天然,顾名思义,便是在动植物体内不存在的氨基酸; 因此,如何编码、转运、插入携带各种官能团(偶联位点)的非天然氨基酸就成了首要解决的问题。 非天然氨基酸抗体偶联技 术 到底有何特点?代表性公司的技术有何差异?本文对此做一简要分析。
tRNA组合物:nnAA偶联技术基石
在蛋白质合成过程中,DNA、mRNA、tRNA、氨基酸和氨酰tRNA 合成酶等功能体及相应的监视系统共同参与。在氨酰 tRNA 合成酶的作用下,每一个 tRNA 与对应的氨基酸结合形成氨酰 tRNA,再通过其反密码子与 mRNA 上的密码子互补,将相应的氨基酸连接到正在合成的多肽链上。
Schultz实验室最早开发出非天然氨基酸蛋白质定点修饰技术,通过在细胞或细菌内引入能够特异性识别非天然氨基酸的外源tRNA以及相对应的氨酰tRNA合成酶,催化特定氨基酸与tRNA结合,在进入核糖体后,识别mRNA上的琥珀终止密码子(UAG),实现定点插入[1]。
在插入非天然氨基酸的过程中,tRNA、氨基酸和氨酰 tRNA 合成酶是相互对应、正交组合的,即一种 tRNA 只能与一种氨基酸结合,氨酰 tRNA 合成酶只能结合一种氨酰 tRNA,否则就无法实现从 DNA 到mRNA 再到蛋白质的严密的信息传递,也就无法合成所需的蛋白质。这种非天然氨基酸正交翻译技术也称之为遗传密码子扩展技术,利用终止密码子在蛋白翻译过程中将非天然氨基酸插入到蛋白质的氨基酸序列中[2]。
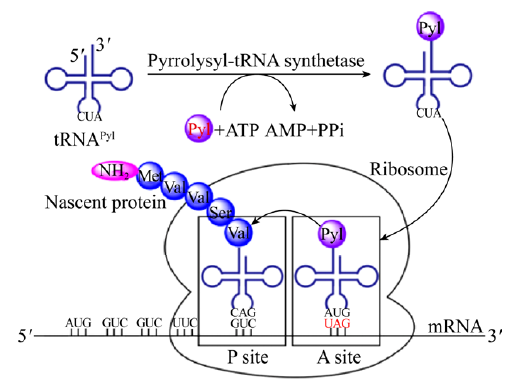
终止密码子之外,四联(五联)密码子和再分配的有义密码子以及引入非天然碱基的特殊密码子等技术也在积极探索。根据文献报道,迄今已实现200多种非天然氨基酸的插入,包括60余种是采用改造的古细菌詹氏甲烷球菌(Methanococcus jannaschi;M. jannaschii)的tRNA/酪氨酰tRNA合成酶正交对插入[3],这也就形成了最初的tRNA组合物。
Ambrx: nnAA偶联技术实践者
作为较早运用非天然氨基酸定点偶联技术的公司,
在2005年就有相关专利申请(CN101273140),涉及正交tRNA、正交氨酰基tRNA合成酶和正交tRNA/合成酶对的组合物,专利要求中声明的tRNA同样来自詹式甲烷球菌。2008年,Ambrx将该技术拓展至脊椎动物细胞(CN101528914)。
Ambrx网站信息显示,基于tRNA/tRNA 细胞株对(正交组),利用专有的细菌平台 (ReCODE 平台™) 或酵母和哺乳动物细胞平台 (EuCODE 平台™) ,Ambrx可以在任何治疗性蛋白质或抗体上进行抗体偶联药物的开发。
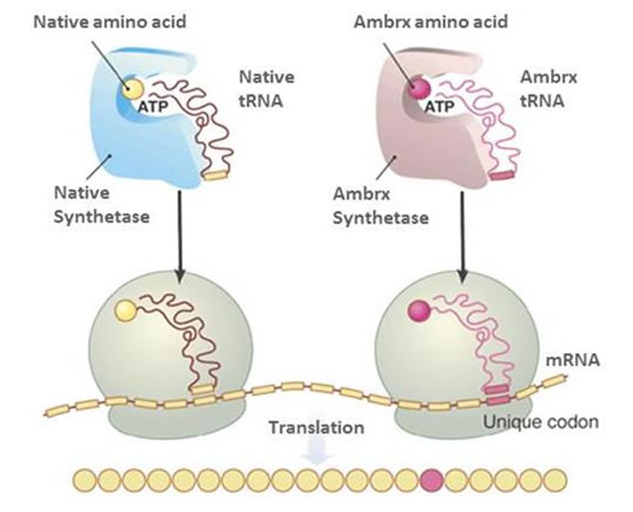
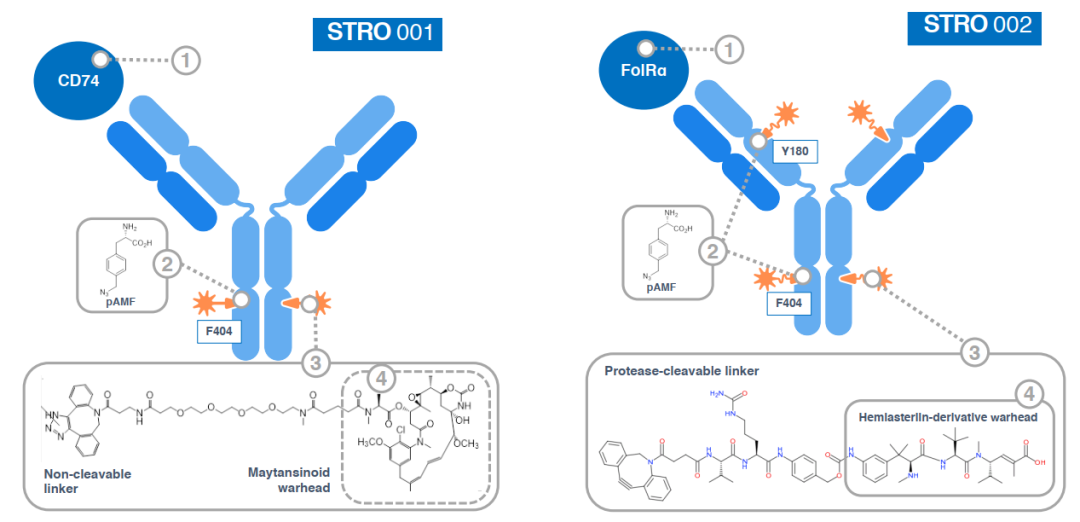
当然,对于引入非天然氨基酸的位点,也不能影响抗体功能,比如疗效、结合力等。ARX788中,毒性载荷的Linker(AS269)结合在HER2单抗重链丙氨酸121和对应的丙氨酸114两个位置,形成DAR值为2(约1.9)的抗体偶联药物。
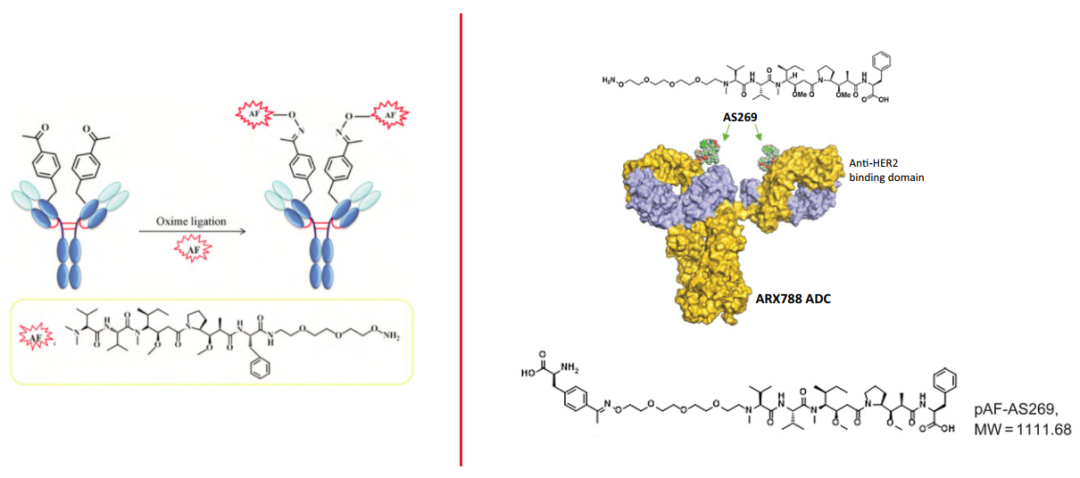
文献[1,4]和专利披露的信息中,Ambrx更多的是探讨引入乙酰基氨基酸,如ARX788,对应的形成类似羟肟的结合形式。Linker与抗体通过肟、腙等形式组成的ADC药物,被质疑在循环中存在不稳定性,Linker容易从抗体脱落导致脱靶毒性。然而,数据显示[4],ARX788具有良好的稳定性。
但是,无论采用原核生物(大肠杆菌)还是真核细胞(酵母)系统,与天然氨基酸存在相应的转运系统不同,非天然氨基酸均涉及如何转运至表达系统中的问题;同时,也存在定点引入和释放因子(RF1/RF2)之间的竞争。而且,对于需要引入不同官能团的非天然氨基酸作为偶联位点时,不可避免需要增加筛选工作。因此,Sutro公司开发了一种体外无细胞蛋白质合成体系,用于开发非天然氨基酸定点插入抗体。
Sutro:nnAA偶联技术持续突破
2010年, Sutro公司申请了一项利用体外蛋白合成系统将非天然氨基酸引入蛋白的专利(CN102348807)。具体来说,涉及使用非正交天然同功有义tRNA,该技术允许通过有义密码子将多个非天然氨基酸并入,而不必依赖正交tRNA-合成酶对。该专利中也披露了Sutro基于细胞(大肠杆菌)来源提取物的体外蛋白合成系统,不需要完整的功能细胞,有望摆脱固定的生化和生物物理参数限制。
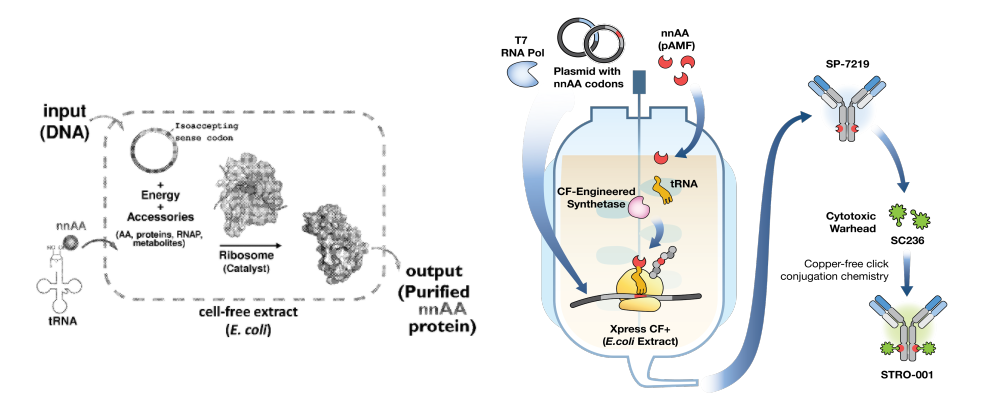 来源:WO2010081111/Sutro网站
来源:WO2010081111/Sutro网站
对于非天然氨基酸携带的官能团,Sutro选择与Synaffix相同的策略( 多项授权合作,Synaffix公司ADC专利技术解析 ),即采用叠氮基修饰,通过与Linker的点击化学反应生成抗体偶联药物。2013年,Sutro提交和发表了相关专利(CN104583235/CN104981254/CN)和文献[5],已公开的2个抗体药物也全部采用了这种氨基酸骨架。
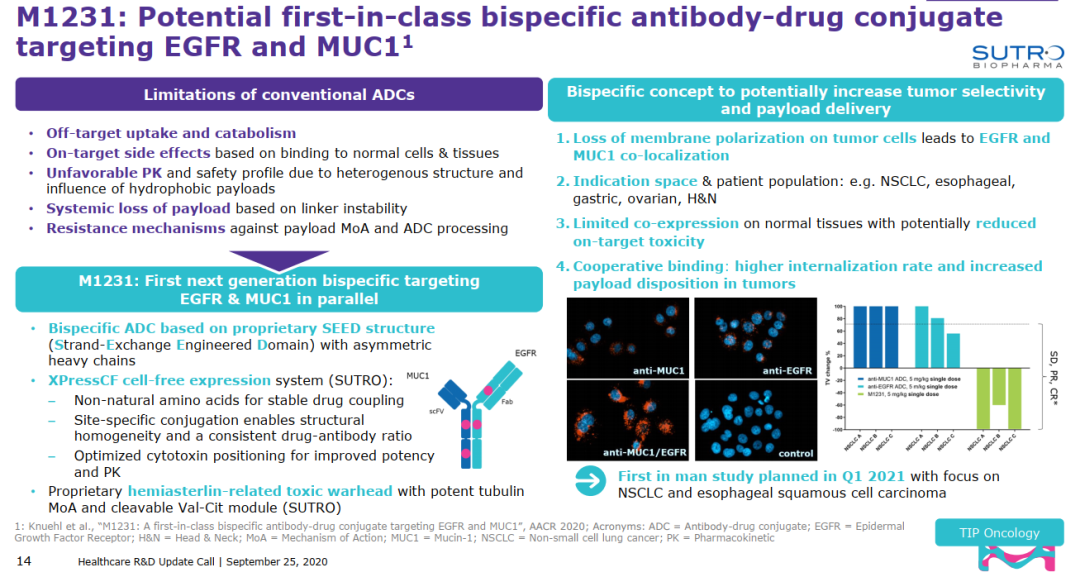
但是,对于Sutro而言,或许M1231更具代表性。M1231是Sutro和默克(EMD Serono)合作开发的一款MUCI/EGFR特异性双抗ADC,已经在2021年1月开始实体瘤适应症的临床研究(NCT04695847)。M1231同样采用非天然氨基酸定点偶联技术,基于Sutro不对称重链专有SEED结构(链交换工程域)和无细胞生产技术平台(XpressCF)开发的一款双靶点的特异性双抗偶联药物,通过可裂解(Val-Cit)接头将潜在基于微观蛋白作用机制的hemiasterlin相关毒性载荷与双特异性抗体偶联,实现结构同质性和稳定DAR。
结语
ADC药物和相关赛道的持续火热,吸引了国内外企业的共同关注。ADC技术也在不断突破和进步,在日新月异的技术变革之下,企业采用哪种ADC技术是影响后续产品开发非常关键的因素之一。而在选定和拥有相应的ADC技术之后,创新性治疗靶标的发现将是企业面临的下一个挑战。
[原文]

